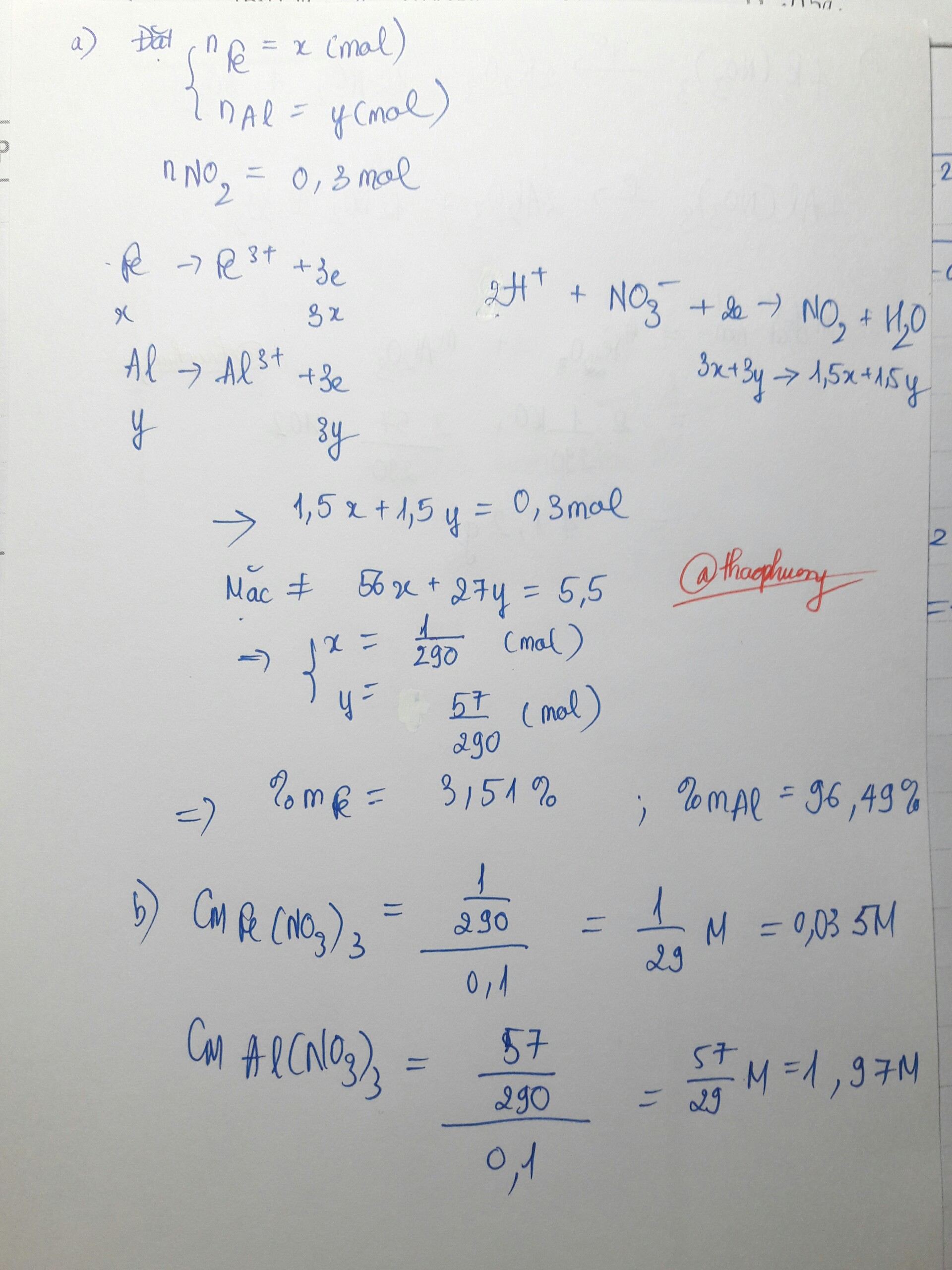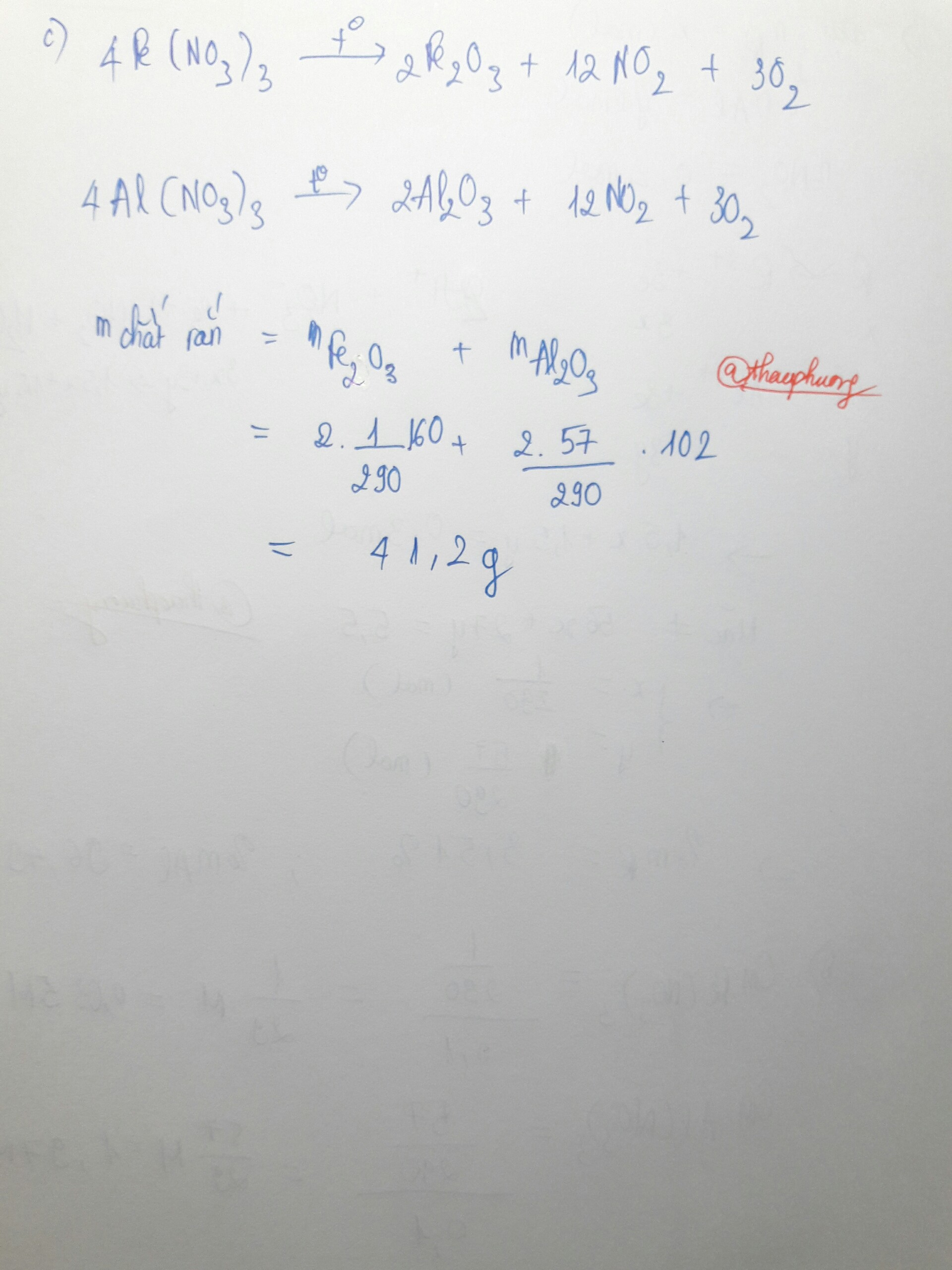Hòa tan 2.22 gam hỗn hợp Al và Fe bằng 500ml dung dịch HNO3 0.5M thu được dung dịch A và 1.12 lit khí duy nhất NO (đktc).
a) Tính % về khối lượng mỗi kim loại trong hỗn hợp đầu?
b)Cho dung dịch A tác dụng với 210ml đ NaOH 1M, rồi lấy kết tủa nung ở nhiệt độ cao thì thu được bao nhiêu gam chất rắn?